Actualité bibliographique du mois de février
Tyrosine kinase-2 inibiteur, une nouvelle voie thérapeutique du psoriasis modéré à sévère - Pauline Bataille et Emilie Sbidian
Thème : THERAPEUTIQUE
Titre : Tyrosine kinase-2 inibiteur, une nouvelle voie thérapeutique du psoriasis modéré à sévère
Kim Papp et al démontre, dans cette étude, l’efficacité et la tolérance de BMS-986165, une molécule inhibant la tyrosine kinase 2 (TYK2), dans le psoriasis modéré à sévère.
Quel est le rôle de la TYK2 ?
La TYK2 2 est une protéine intracellulaire de la famille des Janus kinases (JAK1, 2, 3 et TYK2) permettant la transduction du signal des récepteurs IL-12, IL-23 et interférons. BMS -986165 inhibe TYK2, via son domaine TH2 (pseudokinase) qui modifie la structure conformationnelle du domaine TH1, domaine catalytique de la kinase. Ce mécanisme d’action permet une sélectivité élevée de l’inhibition de TYK2, qui se différencie principalement des autres tyrosines kinases par son domaine catalytique.
Le psoriasis, les maladies intestinales et le lupus érythémateux systémiques sont les principales indications potentielles du ciblage sélectif de TYK2.
L’inhibition de la tyrosine kinase 2 est-il être efficace dans le psoriasis modéré à sévère ?
L’étude présentée dans cet article est une étude de phase II, randomisée, multicentrique (82 sites), internationale, de phase II, en double aveugle et contre placebo.
Les caractéristiques de l’étude étaient :
- Critères d’inclusion: Adultes atteints d’un psoriasis en plaque depuis au moins 6 mois, dont le BMI est compris entre 18 et 40, éligibles pour une photothérapie ou un traitement systémique, ayant une surface corporelle atteinte supérieure ou égale à 10%, un PASI supérieur ou égal à 12 et un score PGA supérieur ou égal à 3.
- Critères d’exclusion : Une autre forme de psoriasis, une autre maladie auto-immune requérant un traitement immunosuppresseur, un antécédent ou l’existence d’une infection active, un terrain à risque de tuberculose, et un antécédent d’échec de réponse à un agent ciblant la même voie thérapeutique.
- Critère de jugement principal : amélioration de 75% ou plus du PASI.
- Critères de jugements secondaires : amélioration de 50%, de 90% et de 100% du PASI, un score PGA de 1 ou 0, un DLQI de 1 ou 0.
- Les patients étaient randomisés pour recevoir une des 5 doses orales de BMS-986165 (3mg tous les deux jours, 3mg par jour, 3 mg deux fois par jour, 6mg deux fois par jour, ou12mg par jour) ou un placebo, selon un ratio 1 :1 : 1 : 1 : 1 :1.
La durée de la prise du médicament était de 12 semaines, additionnée à une période de suivi de 30 jours.
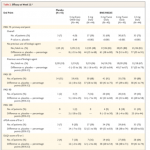
De novembre 2016 à novembre 2017, 268 patients ont été randomisés. Voir figure 1.
Les résultats mettaient en évidence la supériorité de la molécule par rapport au placebo sur le critère de jugement principal ainsi que sur les critères de jugement secondaires (p<0,001) pour toute posologie supérieure ou égale à 3mg par jour : 7% des patients avaient une diminution de plus de 75% du PASI dans le groupe placebo, 9% dans le groupe 3mg tous les deux jours, 39% à 3mg par jour, 69% à 3mg deux fois par jour, 67% à 6mg par jour et 75% à 12mg par jour. L’efficacité du traitement était visible dès le quinzième jour et persistait au cours des 30 jours de suivi.
En termes de tolérance, 51% des patients sous placebo et 55 à 80% des patients dans les groupes BMS-986165 ont eu des effets secondaires, principalement des rhinopharyngite, céphalées, diarrhées, nausées, et infections des voies aériennes supérieures.
Cinq effets secondaires sévères ont été rapportés chez 4 patients : 2 épisodes hémorragiques chez un patient recevant le placebo, une gastroentérite à rotavirus, des épisodes de vertiges et une blessure oculaire accidentelle chez des patients recevant BMS-986165. Il y eut une découverte de mélanome in situ à la dose de 3mg par jour.
En conclusion, la molécule BMS-986165 semble prometteuse dans le traitement du psoriasis modéré à sévère à une posologie supérieure ou égale à 3mg par jour, de par son efficacité et sa tolérance. Un essai randomisé, multicentrique, de phase 3 est actuellement en cours afin d’évaluer l’efficacité de la molécule versus placebo et versus apremilast (clinicaltrial.gov NCT03611751).
Référence de l'article :
Phase 2 trial of selective tyrosine kinase 2 inhibition in psoriasis.
Kim Papp, Kenneth Gordon, Diamant Thaçi, Akimichi Morita, Melinda Gooderham, Peter Foley, Ihab Girgis, Sudeep Kundu, Subhashis Banerjee
N Engl J Med. 2018 Oct 4;379(14):1313-1321. doi: 10.1056/NEJMoa1806382. Epub 2018 Sep 11.